高效液相色谱法测定硫酸羟氯喹片有关物质及方法学验证
摘要
关键词
硫酸羟氯喹;有关物质;高效液相色谱法;方法学验证
正文
HPLC determination of related substances
in Hydroxychloroquine Sulfate Tablets and validation of methodology
LIANG Sheng-hua1 HUANG Jian1 HE Xiong2*
(1.Hunan Jiudian Pharmaceutical Co., Ltd, Changsha 410009;2.Hunan Center for Drug Evaluation and ADR Monitoring, Changsha 410013)
Abstract: Objective To establish a method for the determination of related substances in Hydroxychloroquine Sulfate Tablets by HPLC.Methods HPLC was performed on a C1 8 column(250mm×4.6mm,5μm),with the mobile phase A of Phosphate buffer (0.01 mol·L-1 monopotassium phosphate solution, adjusting pH to 9.0 with triethylamine)-Acetonitrile (72:28),and mobile phase B of methanol for the linear gradient elution.The detection wavelength was 254 nm.The column temperature was 30℃.and the flow rate was 1.0 mL·min-1.Results Each impurity peak in Hydroxychloroquine Sulfate Tablets was completely separated.The calibration curves
were linear in their corresponding ranges,and the recoveries of these impurities were between 95%一105%.Conclusion This simple,accurate method can be used for the determination of related substances in Hydroxychloroquine Sulfate Tablets.
Key words:Hydroxychloroquine Sulfate ;related substance;HPLC;validation of methodology
硫酸羟氯喹属于4-氨基喹酮类抗疟药,此药物在1944年,被成功人工合成,由2个芳香环构成,氯喹中的一个乙基在羟氯喹中被羟基所替代,羟氯喹的药效效力更显著,且毒副作用低。硫酸羟氯喹片(200mg)1955年4月18日首次获FDA批准上市,最初作为抗疟药物使用,上市企业为Concordia Pharms INC。自1950年以来,随着科学的发展,人们发现羟氯喹还有免疫抑制的效果,目前广泛应用于系统性红斑狼疮及风湿性关节炎的治疗[1]。关节僵硬、风湿关节炎、皮肌炎、原发性干燥综合征等疾病用硫酸羟氯喹进行针对性的治疗类,效果十分明显;且目前还在开发其他治疗用途。至1990年以后,90%以上的类风湿病会选用硫酸羟氯喹来进行治疗[2]。
硫酸羟氯喹片在《中国药典》上未见收载,《美国药典》(USP)和《英国药典》(BP)均有收载[3-5]。但是在使用BP片剂标准中的检测方法对有关物质进行检测时,部分可能存在的降解杂质无法被有效的分离检出;USP标准中采用与BP标准中一致的流动相进行有关物质检测,但由于其采用UPLC法,对检测仪器等色谱条件的要求更高。为了解决上述问题,本研究对硫酸羟氯喹片有关物质检测方法实行了改进和研究,创立了准确、方便、专属性强及灵敏度高的硫酸羟氯喹片有关物质高效液相色谱法测定并对其进行了方法学验证。
1 仪器与试药
赛默飞世尔科技有限公司Ultimate3000高效液相色谱仪,auw220d电子天平称(岛津公司)。硫酸羟氯喹片(批号:X220301),硫酸羟氯喹(批号:20200902,纯度:98.7% 对照品自制);杂质a(批号:20200406,纯度:95.45% )(对照品,SZEB公司);杂质b(批号:05-AUG-21-16,纯度:91.30% )、杂质c(批号:22-AUG-21-03,纯度:97.73% )、杂质d(批号:16-JUL-21-04,纯度:94.83% )、杂质e(批号:17-OCT-20-05,纯度:94.07% )、杂质g(批号:23-NOV-18-30,纯度:98.23% )、(对照品,QCC公司),甲基氰(色谱纯,Sigma公司)、羟基甲烷(色谱纯,Sigma公司),其他试剂均为分析纯,水为超纯水。
2 方法及结果
2.1 色谱条件
色谱柱:十八烷基硅烷键合硅胶色谱柱(4.6*250mm,5μm);柱温为30℃;检测波长为254nm;进样量:20μl;流动相:以PBS(用三乙胺调节pH值至9.0,0.01mol/L磷酸二氢钾溶液)-甲基氰(72:28)为流动相A,羟基甲烷为流动相B,按表1进行梯度洗脱;流速:1.0 mL·min-1。
表1 流动相梯度洗脱程序
Tab 1 Gradient elution program of mobile phase
时间/min | 流动相A/% | 流动相B/% |
0 | 78 | 22 |
15 | 78 | 22 |
36 | 35 | 65 |
40 | 78 | 22 |
45 | 78 | 22 |
2.2 系统适用性
取杂质对照品和硫酸羟氯喹对照品适量,用流动相A溶解并稀释制成每1mL中约含硫酸羟氯喹1mg、杂质a、杂质b、杂质e、杂质g2μg,杂质c、杂质d 5μg的溶液,取20μl放到色谱仪中,记录色谱图,硫酸羟氯喹峰与各杂质峰间的分离度均符合标准要求,符合系统适用性要求,如图1。
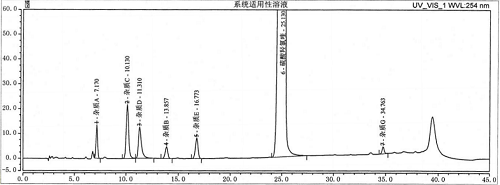
图1 系统适用性色谱图
Fig1 Chromatogram of system suitability
2.3 供试品溶液的配制
将硫酸羟氯喹片碾磨成细粉,使用天平秤称取部分,将流动相A加入其中并充分溶解,定量稀释制成每1mL中含1mg的溶液,过滤,取续滤液作为供试品溶液。
2.4 对照品溶液的配制
使用天平秤取硫酸羟氯喹对照品25mg,放在100ml的量瓶中,用稀释剂溶解后,稀释到指定刻度,精密移取1ml,放在50ml的量瓶中,用稀释剂溶解并稀释到指定刻度,均匀摇晃,即得。
2.5 测定法
使用天平秤提取供试品溶液、对照品溶液各20μl分别注入液相色谱仪,记录色谱图。按加校正因子的主成分外标法计算杂质含量。
3 方法学验证
3.1 专属性
3.1.1 强制破坏试验 空白溶剂及各辅料对有关物质测定不会造成干扰。样品在酸、碱、氧化、光照、高温等条件下破坏得到的杂质峰均与硫酸羟氯喹峰的分离度符合要求(不低于1.5),降解产物峰之间也具有良好的分离度,各破坏条件下主峰纯度因子均大于990。通过比较试验前后总峰面积的变化,物料平衡(A破坏后总峰面积/A破坏前总峰面积×100%)在90%~110%,方法专属性符合要求,结果见表2。
表2强制破坏性试验测定结果
Tab 2 Determination of forced degradation test
破化方式 | 主峰纯度因子 | 物料平衡% |
未破坏 | 995 | / |
酸破坏 | 995 | 100.76 |
碱破坏 | 995 | 102.06 |
高温破坏 | 995 | 102.76 |
氧化破坏 | 997 | 103.21 |
光照破坏 | 997 | 101.78 |
3.1.2 杂质对照品外加法 取杂质a、b、c、d、e、g适量,分别溶解于流动相A后加至供试品溶液中,精密量取20μl注入液相色谱仪,已知杂质无干扰。
3.2 线性关系及检测限和定量限
通过配制六份系列浓度梯度的标准溶液对本方法的线性和范围进行验证。以各杂质浓度为横坐标,峰面积为纵坐标,进行线性回归。将杂质对照品溶液稀释至相应的浓度,根据信噪比10∶1,计算得各杂质的定量限;信噪比3∶1,计算得各杂质的检测限。结果表明杂质a、b、c、d、e、g及硫酸羟氯喹在相应范围内线性符合要求,方法灵敏度符合要求。
表3 杂质线性方程、检测限和定量限结果
Tab 3 Regression equation,LOD and LOQ of impurities
化合物 | 线性方程 | 范围(μg·mL-1) | R2 | 定量限(LOD)/% | 检测限(LOQ)/% |
杂质A | y=0.8636x-0.0047 | 0.5~4.1 | 1.00 | 0.046 | 0.021 |
杂质B | y=0.5617x+0.0047 | 0.5~4.3 | 0.999 | 0.059 | 0.030 |
杂质C | y=0.9820x-0.0240 | 1.3~10.5 | 0.999 | 0.065 | 0.027 |
杂质D | y=0.7307x-0.0626 | 1.3~10.3 | 1.00 | 0.125 | 0.075 |
杂质E | y=1.2122x+0.0073 | 0.5~4.0 | 1.00 | 0.097 | 0.024 |
杂质G | y=0.2291x+0.0022 | 0.5~4.3 | 0.999 | 0.056 | 0.065 |
硫酸羟氯喹 | y=0.8313x-0.0005 | 1.2~9.9 | 1.00 | 0.086 | 0.031 |
3.3准确度、精密度及耐用性试验
通过杂质对照品加样加收试验计算方法准确度;结合重复性和中间精密度判断方法精密度;改变柱温、流动相比例、流动相pH值、色谱柱及波长对方法耐用性进行验证,结果见表4~5,表明该方法适用于硫酸羟氯喹片有关物质检测。
表4 验证项目测定结果
Tab 4 Determination of validation
验证项目 | 验证结果 |
准确度(各杂质在低浓度、中浓度、高浓度下的回收率)
精密度 | 杂质A:95%~97%;杂质B:103%~107%;杂质C:100%~102%;杂质D:96%~104%;杂质E:99%~102%;杂质G:99%~105%;方法准确度符合要求 重复性各杂质绝对值最大变化范围为0.001%~0.006%;中间精密度各杂质绝对值最大变化范围为0.001%~0.009%;符合可接受标准。方法精密度符合要求。 |
表5 耐用性试验结果
Tab 5 Durability test
色谱条件 | 杂质含量% | |||||
杂质A | 杂质B | 杂质C | 杂质D | 杂质E | 杂质G | |
标准条件 | 0.21 | 0.22 | 0.56 | 0.54 | 0.20 | 0.22 |
柱温25℃ | 0.27 | 0.22 | 0.56 | 0.54 | 0.20 | 0.25 |
柱温35℃ | 0.22 | 0.21 | 0.58 | 0.56 | 0.21 | 0.25 |
比例(70:30) | 0.26 | 0.21 | 0.57 | 0.55 | 0.21 | 0.24 |
比例(74:26) | 0.22 | 0.21 | 0.56 | 0.54 | 0.21 | 0.23 |
pH值8.8 | 0.23 | 0.20 | 0.57 | 0.56 | 0.21 | 0.25 |
pH值9.2 | 0.27 | 0.19 | 0.58 | 0.56 | 0.21 | 0.25 |
色谱柱① | 0.22 | 0.19 | 0.55 | 0.55 | 0.21 | 0.24 |
色谱柱② | 0.27 | 0.18 | 0.54 | 0.53 | 0.21 | 0.25 |
波长249nm | 0.20 | 0.21 | 0.57 | 0.56 | 0.21 | 0.25 |
波长259nm | 0.19 | 0.21 | 0.56 | 0.54 | 0.21 | 0.28 |
3.4样品测定
取硫酸羟氯喹片样品3批,按“2.3”项下方法制备供试品溶液,采用“2.1”项下色谱条件测定有关物质,结果见表6。在三批硫酸羟氯喹片中均未检出杂质E和杂质G,杂质A、杂质B、杂质C和杂质D的量均较小。
表6 硫酸羟氯喹片有关物质测定结果(%)
Tab 6 Determinatian of related substences in samples(%)
厂家 | 规格 | 批号 | 杂质A | 杂质B | 杂质C | 杂质D | 杂质E | 杂质G | 其他最大单杂 | 总杂 |
九典制药 | 0.2g | 20220303 | 0.058 | 0.004 | 0.025 | 0.005 | 未检出 | 未检出 | 0.008 | 0.123 |
20220304 | 0.060 | 0.003 | 0.028 | 0.003 | 未检出 | 未检出 | 0.008 | 0.127 | ||
20220305 | 0.061 | 0.004 | 0.030 | 0.004 | 未检出 | 未检出 | 0.006 | 0.124 |
4讨论
《英国药典》的检测方法无法完全有效分离检测出硫酸羟氯喹原料药和片剂的质量标准中所提及的可能存在各杂质(包括原料药合成路径中可能产生的工艺杂质和降解杂质);《美国药典》的UPLC法对色谱仪器要求较高;硫酸羟氯喹片进口注册标准JX20180042[12]中加入离子对试剂进行有关物质检测,对色谱柱及仪器的损伤较大,成本较高。相比上述各已有的标准中有关物质检测方法,本研究建立的硫酸羟氯喹片有关物质分析方法,能在使用仪器要求较低的普通高效液相色谱仪和成本更低更易获得的试剂时就能更有效的分离检出可能存在的杂质,且简单、灵敏,专属性高,适用于硫酸羟氯喹片有关物质的检测。
参考文献:
[1]黄伟. 羟氯喹研究进展及在皮肤科的应用 [J]. 右江民族医学院学报,2010, 32(4): 612-614.
[2]卢家俐, 赵铖. 羟基氯喹在风湿性疾病中的应用进展[J]. 内科, 2008, 3(1): 69-71.
[3] The United States Pharmacopeial Convention[S].Inc.USP43-NF38,2021:2259.
[4] The British Pharmacopeial Convention[S].Ine.BP2021,2020:958- 959.
[5]国家药典委员会.中华人民共和国药典(二部)[Z]北京:化学工业出版社,2020
[6]硫酸羟氯喹片进口注册标准JX20180042[S].
...